日前,卫浴行业领军品牌恒洁官宣品牌升级大动作,不仅正式将品牌主张升级为.........
作为美食爱好者,很喜欢给家人健康的饮食,孩子十岁,喜欢吃面包、蛋糕等西式点心;家里还有老人,更爱中国传统美食;做蒸食不仅有传......
新居装修,今天就有友友家里新添了一款新颖的吊灯灯饰,下面我们就来看看他的吊灯是怎么样的。来说一下整个安装过程吧。其实这灯也......
伴随国民经济的腾飞以及建筑业的不断扩张,我国防水材料行业也进入高速发展时期.........
5月份,医疗器械行业将执行哪些新规?让我们来一起看下8。
国家新规
I、医疗保障基金飞行检查管理暂行办法
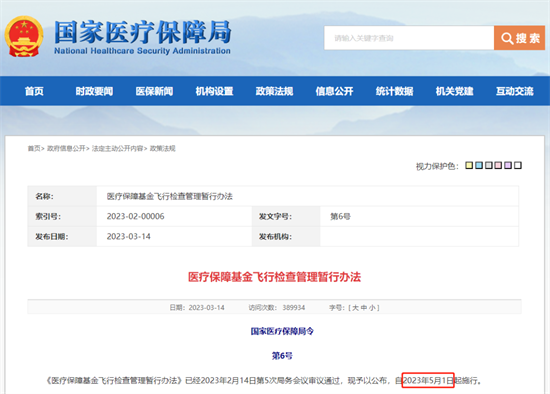
第十条 有下列情形之一的,医疗保障行政部门可以启动飞行检查:
(一)年度工作计划安排的;
(二)举报线索反映医疗保障基金可能存在重大安全风险的;
(三)医疗保障智能监控或者大数据筛查提示医疗保障基金可能存在重大安全风险的;
(四)新闻媒体曝光,造成重大社会影响的;
(五)其他需要开展飞行检查的情形。
此《办法》强化了飞行检查机制,规范了飞行检查程序,是医保部门未来开展飞行检查的制度保障,其正式施行将提升飞行检查效能,对维护医保基金安全具有促进作用。
II、国家药品监督管理局关于GB 9706.1-2020及配套并列标准、专用标准实施有关工作的通告(2023年第14号)
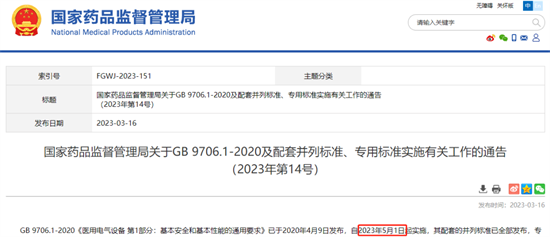
此文件从严格执行相关标准要求、注册备案相关标准执行要求、检验相关标准执行要求、强化标准实施监督管理等四个方面,对产品注册人备案人、技术审评、检验、监督管理等环节的工作开展提出了明确要求。
地方新规
I、海南自由贸易港博鳌乐城国际医疗旅游先行区临床急需进口药品医疗器械管理规定
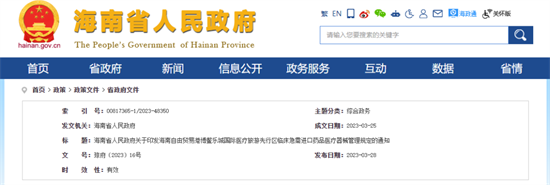
海南省人民政府发布的《海南自由贸易港博鳌乐城国际医疗旅游先行区临床急需进口药品医疗器械管理规定》自2023年5月1日起施行。
《规定》提出36条规定,明确了对乐城先行区进口已在境外批准上市,未获我国批准注册、国内已上市品种无法替代的药品(不包括疫苗)或已在境外批准上市且在我国尚无同品种产品获准注册的医疗器械在申请、流通、使用、监管等环节的具体管理要求。

II、湖南省药品监督管理局关于互联网药品信息服务许可等部分药品、医疗器械行政审批事项实行电子证照的公告
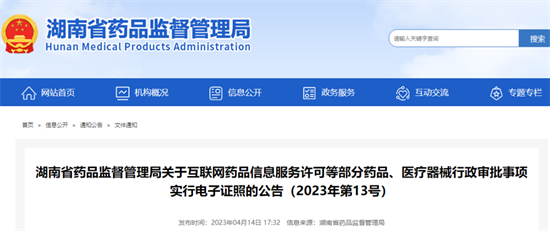
自2023年5月1日起,根据《医疗器械网络销售监督管理办法》提出医疗器械网络交易服务申请并获准核发、变更的企业,开始发放医疗器械网络交易服务第三方平台电子备案凭证。此前已发放的纸质证照(证明文件)在有效期内依然有效。
欧盟新规
今年5月26日起,欧盟地区UDI实施范围将扩展至Ⅱa、Ⅱb类器械和Ⅲ类-可重复使用器械、D级体外诊断试剂。目前,欧盟地区已完成植入式器械及Ⅲ类器械的UDI实施工作。计划出口欧盟且产品包含这4类器械的企业,需要注意一下了,赶早不赶晚。
顺便提及一下,欧盟的实施UDI的时间节点&分类规则:
I、时间节点:根据欧盟医疗器械新规《EU-MDR》要求,在欧盟境内上市销售的医疗器械及体外诊断设备,在如下日期前应载有UDI标识:1.2021年5月26日,植入及Class-III类器械产品(暂不强制数据库申报);2.2023年5月26日,Class II-A&B类器械产品,Class D 类体外诊断设备;3.2025年5月26日,Class I 类器械产品,Class C、B 类体外诊断设备;4.2027年5月26日,Class A 类体外诊断设备;II、分类规则:
欧盟划分医疗器械产品风险登记的原则是从医疗器械之设计及制造对人体可能带来的危险程度来进行考量的。目前医疗器械的大类分为医疗器械一、二、三类产品,但由于二类产品又分出了不同的子类,因此实际上可将医疗器械分为以下4类:
①Class I 低风险 (Low risk) ,其中 Is、Im、Ir类:灭菌器械(s)、带测量功能器械(m)、重复使用外科器械(r)
②Class IIa 低到中风险 (Low to medium risk) ,包括普通非植入器械和普通植入器械。
③Class IIb 中风险 (Medium risk) ,包括技术成熟的植入器械和技术不成熟的植入器械、植入器械、MDR附录VIII第12条规定的器械。
④Class III 高风险 (High risk) ,包括特殊非植入器械和特殊植入器械、MDR附录VIII第21条规定的器械。

温馨提示:本文观点为作者个人观点,不代表本站立场,请读者自行参考,另本站部分文章来自网络,如有侵权请联系本站删除。
本站文章包括原创文章支持自由转载,本文章“这些医疗器械的新规定,5月起实行!”转载网址:http://www.xiangmu168.com/qyzx/7357.html,转载请注明出处:文章出处168项目招商网http://www.xiangmu168.com/,谢谢支持!